重磅:三大征求意見一夕轉(zhuǎn)正, 化學(xué)藥品注射劑一致性評(píng)價(jià)正式開始!
一、參比制劑選擇成為注射液一致性評(píng)價(jià)的絕對(duì)前提條件
“通告”明確指出藥品上市許可持有人應(yīng)當(dāng)依據(jù)國(guó)家藥品監(jiān)督管理局發(fā)布的《仿制藥參比制劑目錄》選擇參比制劑,并開展一致性評(píng)價(jià)研發(fā)申報(bào)。尚未收載入《仿制藥參比制劑目錄》的品種,藥品上市許可持有人應(yīng)當(dāng)按照《國(guó)家藥監(jiān)局關(guān)于發(fā)布化學(xué)仿制藥參比制劑遴選與確定程序的公告》(2019年第25號(hào))規(guī)定申報(bào)參比制劑,待參比制劑確定后開展一致性評(píng)價(jià)研發(fā)申報(bào)。
二、明確申報(bào)資料要求
《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評(píng)價(jià)申報(bào)資料要求》結(jié)合“120號(hào)文”和“80號(hào)文”的要求,明確了注射劑一致性評(píng)價(jià)資料要求,更適合注射劑一致性評(píng)價(jià)的特點(diǎn)。
三、明確注射劑一致性評(píng)價(jià)的時(shí)效
“通告”明確了注射劑一致性評(píng)價(jià)依然遵循《關(guān)于仿制藥質(zhì)量和療效一致性評(píng)價(jià)有關(guān)事項(xiàng)的公告》(2018年第102號(hào))的相關(guān)要求。根據(jù)“102號(hào)文”規(guī)定化學(xué)藥品新注冊(cè)分類實(shí)施前批準(zhǔn)上市的含基本藥物品種在內(nèi)的仿制藥,自首家品種通過一致性評(píng)價(jià)后,其他藥品生產(chǎn)企業(yè)的相同品種原則上應(yīng)在3年內(nèi)完成一致性評(píng)價(jià)。逾期未完成的,企業(yè)經(jīng)評(píng)估認(rèn)為屬于臨床必需、市場(chǎng)短缺品種的,可向所在地省級(jí)藥品監(jiān)管部門提出延期評(píng)價(jià)申請(qǐng),經(jīng)省級(jí)藥品監(jiān)管部門會(huì)同衛(wèi)生行政部門組織研究認(rèn)定后,可予適當(dāng)延期。逾期再未完成的,不予再注冊(cè)。需要進(jìn)行一致性評(píng)價(jià)的企業(yè)需要加快腳步了。
四、特殊注射劑研究思路明確
《化學(xué)藥品注射劑(特殊注射劑)仿制藥質(zhì)量和療效一致性評(píng)價(jià)技術(shù)要求》明確了特殊注射劑應(yīng)基于制劑特性和產(chǎn)品特征,采取逐步遞進(jìn)的對(duì)比研究策略,通常首先開展受試制劑與參比制劑藥學(xué)及非臨床的比較研究,然后進(jìn)行人體生物等效性研究,必要時(shí)開展進(jìn)一步的臨床研究。對(duì)于藥學(xué)研究、非臨床研究和臨床研究都有了比較明確的要求。

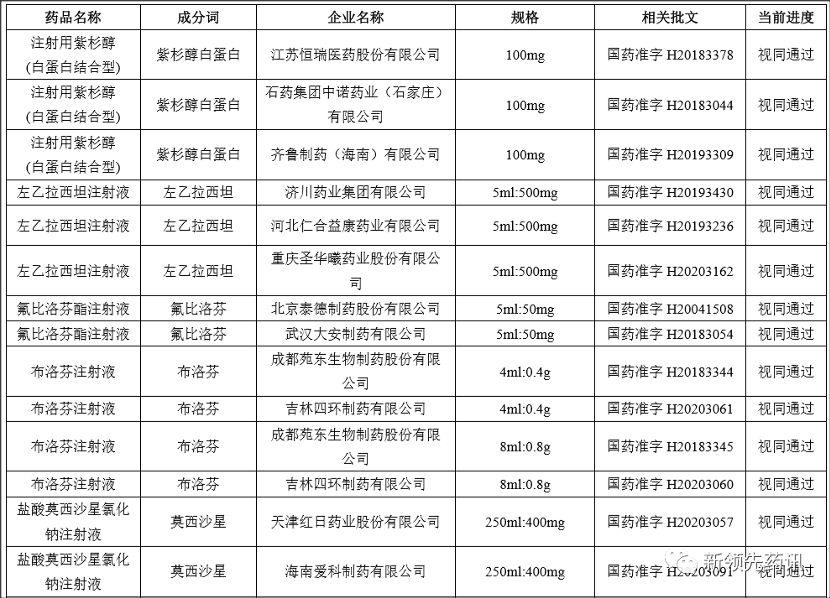
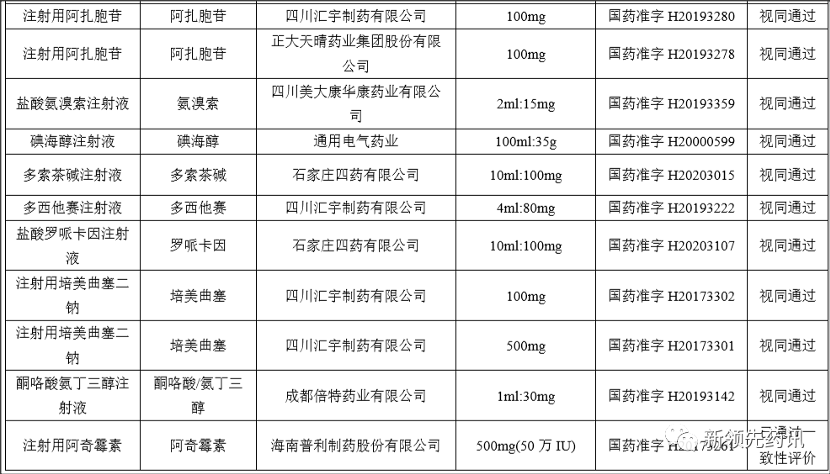
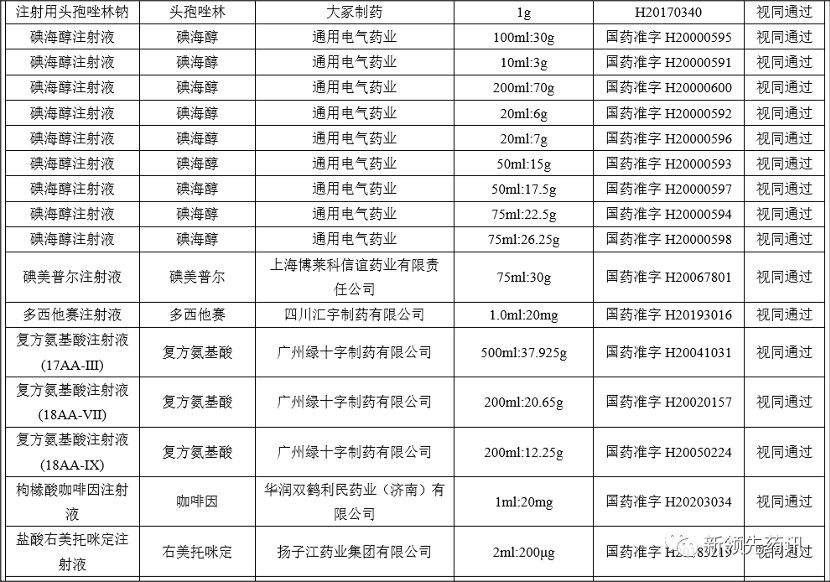
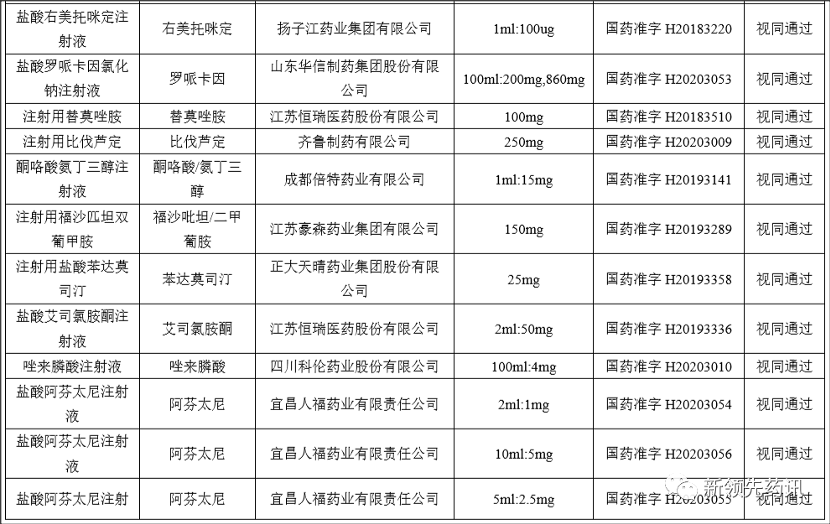
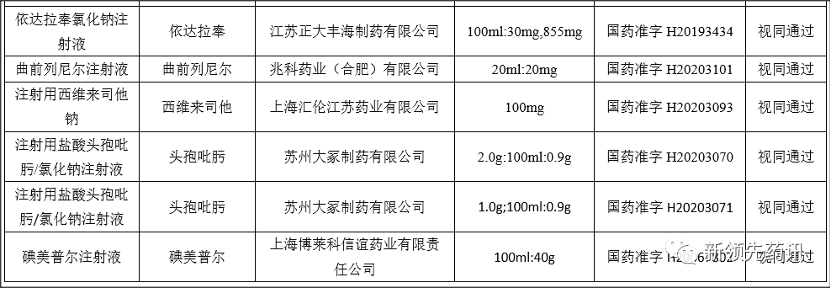
附件:化學(xué)藥品注射劑一致性評(píng)價(jià)進(jìn)度
轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-83057670
Hotline服務(wù)熱線:010-83057670
 簡(jiǎn)體中文
簡(jiǎn)體中文

 010-83057670
010-83057670 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
