政策法規(guī) || 《藥物Ⅰ期臨床試驗管理指導(dǎo)原則》(附法規(guī)概覽6.23-6.27)
發(fā)布時間:2025-06-27
本周熱點
01
國家藥品監(jiān)督管理局食品藥品審核查驗中心關(guān)于發(fā)布《藥物Ⅰ期臨床試驗管理指導(dǎo)原則》的通告
為進一步提高藥物Ⅰ期臨床試驗和生物等效性試驗質(zhì)量和管理水平,國家藥監(jiān)局核查中心組織修訂了《藥物Ⅰ期臨床試驗管理指導(dǎo)原則》(見附件)。經(jīng)國家藥品監(jiān)督管理局同意,現(xiàn)予發(fā)布,自發(fā)布之日起施行。
掃描圖中二維碼
查看詳細信息

NMPA
01
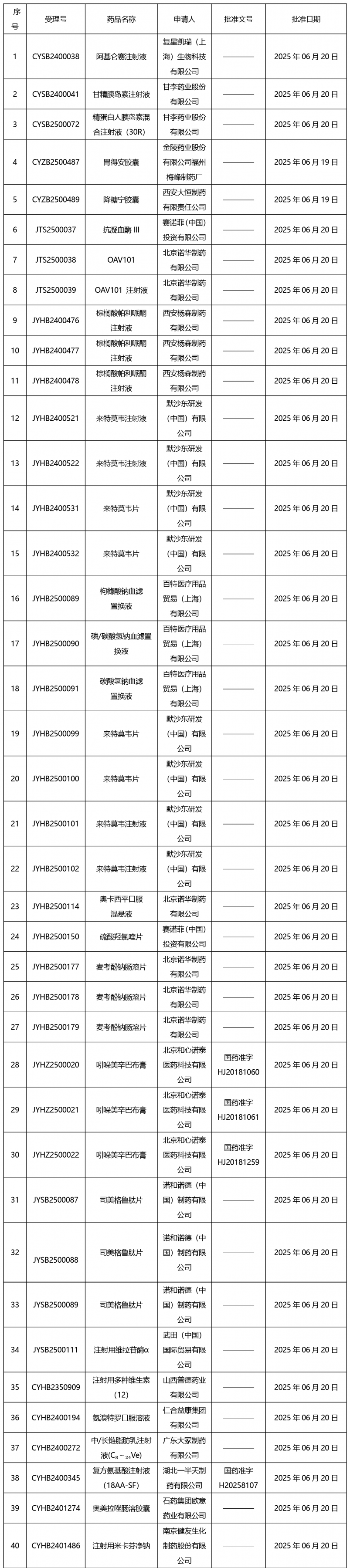
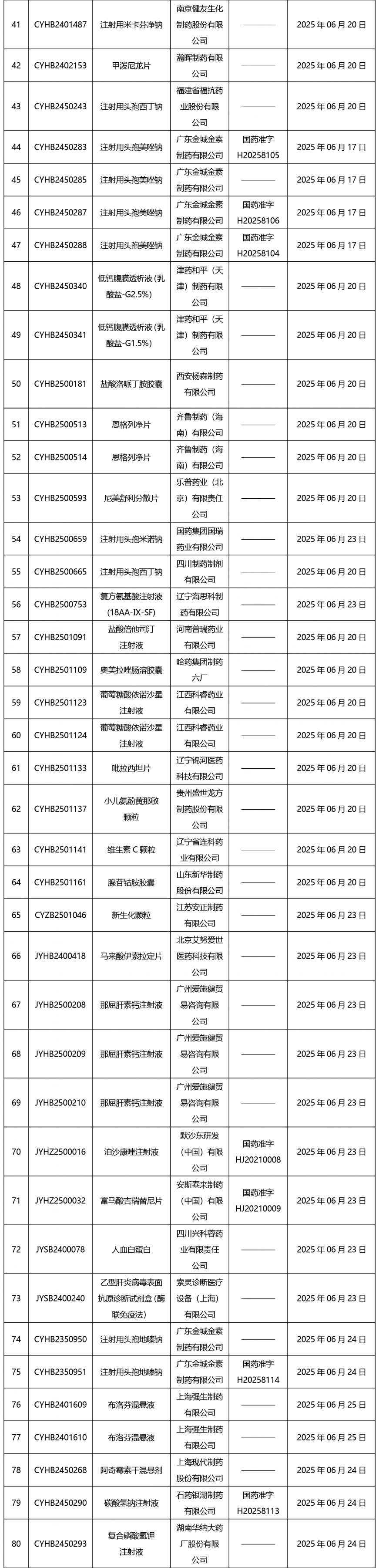
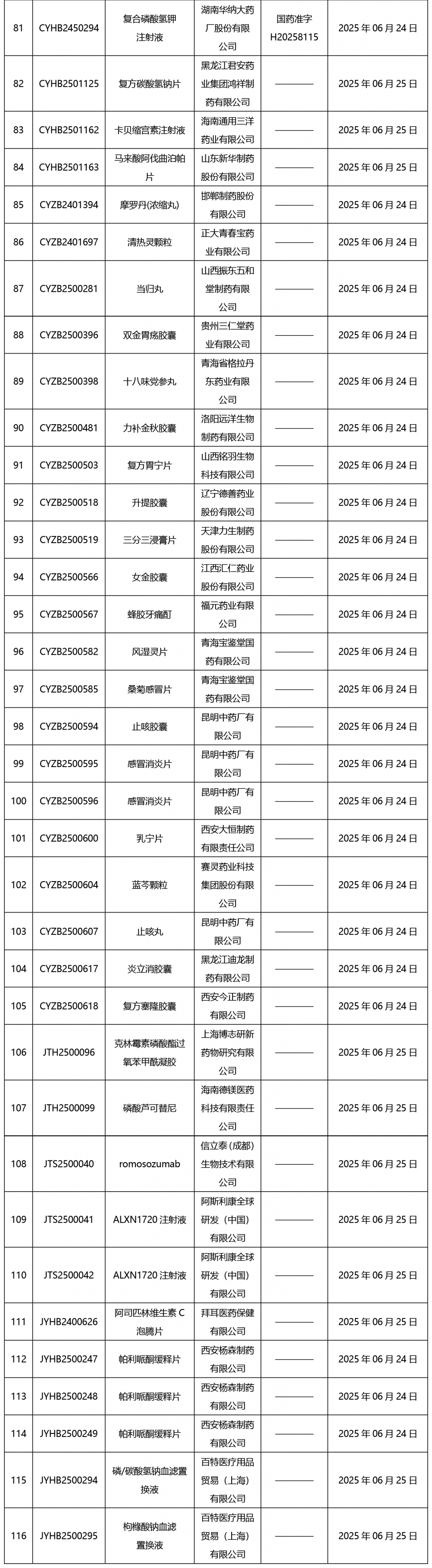
本周(截止到6月27日17:00)共發(fā)布藥品批準證明文件送達信息116個。
藥典委
01
關(guān)于對WHO INN Plist132生物制品中文通用名稱的公示

掃描圖中二維碼
查看詳細信息

-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-83057670
Hotline服務(wù)熱線:010-83057670
 簡體中文
簡體中文

 010-83057670
010-83057670 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
